Amoniak je roztok amoniaku nebo hydroxidu amonného. Chemická látka se aktivně používá nejen v lékařství, ale také v domácí sféře. Hydroxid amonný se používá jako potravinářská přísada E527. Tato látka patří do kategorie emulgátorů. Vzhledem ke svým fyzikálním a chemickým vlastnostem se hydroxid amonný používá jako regulátor kyselosti. V hodinách chemie v 10. ročníku se učí vzorec pro hydrolýzu roztoku čpavku.

Krátký popis
V evropských jazycích zní název pro amoniak (obecný vzorec je NH3) jako „amoniak“. Tato chemikálie vděčí za svůj název oáze Ammon, která se nachází na křižovatce karavanních cest v severní Africe. Močovina (NH2)2CO, která je obsažena v živočišných odpadech, se nejrychleji rozkládá v horkém klimatu. V důsledku této reakce se tvoří NH3.
Existuje názor, že čpavek dostal své jméno od slova „amonský“, které existovalo ve starověkém egyptském jazyce. Tak se nazývali lidé, kteří uctívali boha Amona.
Při různých rituálních rituálech lidé vdechovali čpavek, který při zahřátí odpařoval čpavek.
NH4OH (hydrát amoniaku) se používá v moderním průmyslu jako potravinářská přísada E527. Mnoho výrobců je zvyklých používat pro emulgátor jiné názvy. Například hydroxid amonný. Roztok je bezbarvý, ale má charakteristický zápach. Potravinářské aditivum je vysoce rozpustné v H2O. Při výrobě se nejčastěji používají suroviny syntetického původu. Tou může být čpavková voda, která se získává spojením vody a kokosového plynu.

Hlavním účelem použití aditiva E527 — regulace úrovně kyselosti. Laboratorní studie ale ukázaly, že NH3 H2O je pro lidské tělo nebezpečný, a proto je tato látka v mnoha zemích zakázána. Potravinářské aditivum E527 lze používat v Rusku, na Ukrajině a v zemích EU.
Hydroxid amonný je alkalický a v nezředěném stavu může způsobit vážné chemické popáleniny. NH4OH může způsobit alergickou reakci a podráždit nejen sliznice, ale i pokožku. Z tohoto důvodu je NH3·H2O obsažen v kosmetických přípravcích v maximální koncentraci 6 %. Roztok amoniaku je přítomen v barvách na vlasy, ale ne více než 3%. Negativním účinkům kosmetiky na tělo se lze vyhnout, pokud kupované přípravky neobsahují čpavkovou vodu.
Způsoby, jak se dostat
V průmyslu se NH4OH vyrábí přímým působením kyseliny dusičné (HNO3) a vodíku. Například: N2 (g) + 3H2 (g) ↔ 2NH3 (g) + 45,9 kJ. Fyzikálně-chemické základy této metody vyvinul německý vědec Haber. Reakce nastává s poklesem tlaku a uvolněním tepla. Použití katalyzátoru může výrazně urychlit dosažení rovnovážného stavu. Vědci byli schopni zjistit, že pro výrobu amoniaku musí být tlak 350 atmosfér. Optimální teplota je +500 °C. Při použití katalyzátoru je výtěžek NH4OH do 30 %.
V průmyslovém prostředí se používá osvědčená cirkulační metoda. Amoniak se odstraní ochlazením a včas nezreagovaný vodík a dusík se vrátí do syntézní kolony. Tento přístup je ekonomičtější.
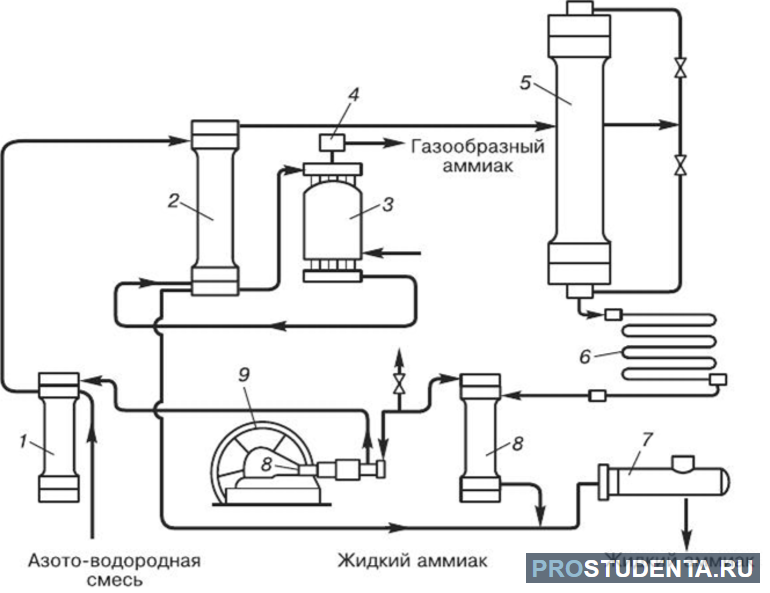
V laboratorních podmínkách se k výrobě amoniaku využívá principu působení silných alkálií na amonné soli: NH4Cl + NaOH = NH3↑ + NaCl + H2O. Kromě toho lze použít nízké zahřívání směsi chloridu amonného a hašeného vápna. Tuto chemickou reakci lze zapsat následovně: 2NH4Cl + Ca (OH)2 = CaCl2 + 2NH3↑ + 2H2O. K vysušení NH3 se kapalina vede přes speciální směs vápna a hydroxidu sodného.
Nejsušší amoniak lze získat rozpuštěním NaOH v něm a následnou destilací. K tomu je nejlepší použít speciální vakuovou jednotku z odolného kovu. V opačném případě nebude použit vysoký tlak. V průmyslovém sektoru se amoniak suší pouze v absorpčních kolonách.
Princip struktury
Molekula NH3 se skládá ze tří atomů vodíku a jednoho atomu dusíku. Vzniklá vazba je kovalentní. Pod mikroskopem můžete vidět, že molekula amoniaku připomíná trojúhelníkovou pyramidu. Okamžitě 3 volné elektrony jsou v 2p orbitalu dusíku. Typ hybridizace sp3 vzniká přidáním tří atomů vodíku. Pokud se pokusíte nahradit vodík uhlovodíkovým radikálem (CnHm), dostanete nakonec zcela novou organickou látku – amin. 3 atomy vodíku mohou být nahrazeny najednou, díky čemuž se tvoří následující typy aminů:
- Hlavní. Methylamin (CH3NH2).
- Sekundární. Dimethylamin (CH3-NH-CH3).
- Terciární. Trimethylamin (CH3-N-(CH3)2).
Na molekuly amoniaku mohou být navázány různé chemické látky, které obsahují několik atomů vodíku a uhlíku.
Například (C2H4)2, C2H4 a C6H4. Aminy a amoniak mají podobné vlastnosti, protože si zachovávají volný pár elektronů dusíku.
Chemické vlastnosti
Ve složení NH4OH je oxidační stav vodíku +1, dusíku -3. Vodný roztok amoniaku má slabě alkalické vlastnosti. Za různých podmínek může hydroxid amonný vykazovat vlastnosti nerozpustné a rozpustné zásady. V důsledku reakce hydrogenuhličitanu sodného (NaHCO3) a amoniaku (NH3) vznikají Na2CO3 a (NH4)2CO3. Existuje několik vlastností, které mohou potvrdit, že čpavková voda je zásaditá:

- V důsledku interakce s kyselinami se tvoří kyselé a střední soli. Chemické reakce lze zapsat takto: 2NH3 H2O + H2SO3 → NH4HSO3, 2NH3 H2O + H2SO3 → (NH4)2SO3 + 2H2O.
- Barva indikátoru se změní. Lakmusový papírek zmodrá, methylová oranž zežloutne a fenolftalein zbarví karmínově.
- Amoniakální voda reaguje s kyselými oxidy, což má za následek tvorbu solí. Například: SO3 + 2NH3 H2O → (NH4)2SO4 + 2H2O.
- NH4OH reaguje se solemi: 3NH3 H2O + AlCl3 → Al (OH)3 + 3NH4Cl.
Roztok amoniaku a nerozpustné zásady jsou si navzájem podobné, protože reagují s kyselinami a snadno se rozkládají (NH3·H2O → NH3 + H2O). Ale tyto chemikálie nereagují s amfoterními kovy, stejně jako jejich hydroxidy a oxidy. NH4OH jako výsledek interakce s manganistanem draselným vykazuje své redukční vlastnosti. Například: 2NH4OH + 2KMnO4 → 2MnO2↓ + N2↑ + 2KOH + 4H2O.
Působením amoniaku na chlorid stříbrný (AgCl + NH3) dochází ke vzniku komplexní soli – diaminchloridu stříbrného. Navíc lze použít (NH3OH)Cl (hydroxylaminiumchlorid).
Díky svým chemickým vlastnostem NH4H získala velkou poptávku v tradiční medicíně, v oblasti hromadné výroby různých barviv, hnojiv (například dusičnanu amonného NH4NO3), sody. V domácím průmyslu se čpavková voda používá k čištění nábytku, skla a textilií od nečistot.
Fyzikální charakteristiky
Amoniak je bezbarvý plyn, který má štiplavý zápach. NH3 je mnohem lehčí než vzduch a je náchylný k rozpouštění ve vodě. Například jeden objem vody dokáže rozpustit až 20 objemů amoniaku. Koncentrovaný kapalný NH700 obsahuje 3 % chemikálie. Hustota roztoku je do 25 g/cm0.91. Všechny vazby mezi atomy v molekule amoniaku jsou kovalentní. V hodinách chemie se dozvíte, že typ molekuly lze zapsat jako AB3. NH3 se vyznačuje geometrickou strukturou typu AB3E (trigonální pyramida).
Amoniak zkapalňuje při teplotě -33 °C. Po ochlazení na -78 °C chemikálie ztuhne. NH3 pomáhá rozpouštět organické a anorganické látky, ale nevede elektrický proud.

Vlastnosti roztoku čpavku vedly k tomu, že se tato látka používá jako spolehlivý lék první pomoci k vyvolání dýchání a vyvedení člověka z mdloby. Lokálně se kapalina používá jako pleťová voda na bodnutí hmyzem a také k účinné neutralizaci kyselých toxinů, které jsou fixovány v hadím kousnutí.
Koncentrovaný roztok amoniaku je dobrým rozpouštědlem pro velké množství organických a anorganických sloučenin. Při správném použití může NH4OH rozpouštět alkalické zeminy, alkalické kovy a další látky. Například jód, fosfor, síra. Chloridové, dusičnanové a bromidové soli jsou mírně rozpustné v kapalném amoniaku. NH3 neovlivňuje soli kyseliny octové, uhličité a fosforečné. Čpavek je ve své čisté formě dielektrikum, a proto může vytvářet statickou elektřinu na stěnách lodí.
Сферы применения
Statistiky potvrzují, že NH3 zaujímá jedno z předních míst na světě z hlediska objemu výroby. Ročně se vyrobí až 180 milionů tun této chemické sloučeniny. Koncentrovaný NH3 se prodává ve formě roztoku. Můžete si zakoupit NH4OH, který obsahuje maximálně 25 % hlavní chemikálie. Velké objemy NH3 se používají k výrobě HNO3 (kyseliny dusičné), která je potřebná pro hromadnou výrobu hnojiv a dalších produktů. Z amoniaku získáváme:
- Močovina (CH4N2O).
- Amonné soli.
- Urotropin.

NH4OH se často používá jako levné chladivo, pokud jde o průmyslové chladicí jednotky. Díky čpavku lze získat syntetická vlákna. Například nylon, nylon. V lehkém průmyslu se NH4OH používá k čištění a následnému barvení vlny, bavlny a hedvábí. NH3 je velmi žádaný v petrochemickém průmyslu, protože dokáže neutralizovat kyselý odpad.
V průmyslu přírodního kaučuku se NH4OH používá ke konzervaci latexu, když je potřeba dopravit surovinu na místo zpracování.
Pokud se soda vyrábí metodou Solvay, pak je nepostradatelný amoniak. V ocelářském průmyslu se NH4OH používá k nitridaci (proces sycení všech povrchových vrstev oceli dusíkem), protože díky tomuto přístupu lze výrazně zvýšit tvrdost materiálu. Pouze správným používáním roztoku čpavku se lze vyhnout toxickým účinkům na lidské tělo, aniž by došlo k poškození životního prostředí.
Amoniak (NH3) je ve vodě rozpustnější než všechny ostatní plyny.
Za normálních podmínek se v jednom objemu vody může rozpustit 1200 objemů amoniaku.
Vypočítejte hmotnostní zlomek amoniaku v roztoku nasyceném za těchto podmínek (hustota vody – 1.

Výpočet na 1 litr (1000 g) vody.
W(NH3) = 1200*17/22(4 + 1000) = 910 nebo 7 %.

Ve 2 litrech vody bylo za normálních podmínek rozpuštěno 44 litru čpavku?
Ve 2 litrech vody bylo za normálních podmínek rozpuštěno 44 litrů amoniaku.
Hustotu roztoku lze považovat za rovnou hustotě čisté vody.
Jaká bude molární koncentrace roztoku?

Amoniak je vodný roztok amoniaku?
Amoniak je vodný roztok amoniaku.
V lékárně se pro získání amoniaku rozpustilo 300 litrů amoniaku (j.n.) ve 112 g vody.
U). Vypočítejte hmotnostní zlomek (v %) amoniaku ve výsledném roztoku.
PROSÍM POMOC PROSÍM.
Pokud možno podrobněji.

Ve 150 litrech vody bylo rozpuštěno 33 litrů čpavku, jehož hustota je 6 g/cm0?
Ve 150 litrech vody bylo rozpuštěno 33 litrů amoniaku, jehož hustota je 6 g/cm0.
Najděte hmotnostní zlomek amoniaku ve výsledném roztoku.

Amoniak (NH600) V = 3 ml (n?) byl rozpuštěn ve vodě o hmotnosti 560 g.
Amoniak (NH600) V = 3 ml (N) byl rozpuštěn ve vodě o hmotnosti 560 g.
U). Určete hmotnostní zlomek amoniaku ve výsledném roztoku.

V jednom objemu vody při n?
V jednom objemu vody při N.
U. rozpouští 1173 objemů čpavku.
Vypočítejte hmotnostní zlomek amoniaku ve výsledném roztoku.

Za účelem získání amoniaku bylo 56 ml amoniaku rozpuštěno ve vodě 200 g?
Za účelem získání amoniaku bylo 56 ml amoniaku rozpuštěno ve 200 g vody.
Je nutné vypočítat hmotnostní zlomek roztoku hydroxidu amonného.

Amoniak o objemu 600 d byl rozpuštěn ve vodě o hmotnosti 448 g?
Amoniak o objemu 600 d byl rozpuštěn ve vodě o hmotnosti 448 g.
Určete hmotnostní zlomek amoniaku ve výsledném roztoku.

Jaký objem amoniaku, měřeno za standardních podmínek, bude potřeba k úplné neutralizaci 20 ml roztoku s hmotnostním zlomkem kyseliny sírové 3 % a hustotou 1 g/ml?
Jaký objem amoniaku, měřeno za normálních podmínek, bude zapotřebí k úplné neutralizaci 20 ml roztoku s hmotnostním zlomkem kyseliny sírové 3 % a hustotou 1 g/ml.

Jaký objem amoniaku (n?
Jaký objem amoniaku (N.
U.) musí projít 50 g 5% roztoku amoniaku, aby se získal nasycený roztok (rozpustnost amoniaku je 89 g ve 7 g vody)?

V 600 g vody bylo rozpuštěno 448 litrů NH3 (amoniak) Určete hmotnostní zlomek amoniaku v roztoku?
V 600 g vody bylo rozpuštěno 448 litrů NH3 (amoniak), stanovte hmotnostní podíl amoniaku v roztoku.
Přešli jste k otázce: Je amoniak (NH3) rozpustnější ve vodě než všechny ostatní plyny? Patří do kategorie Chemie, pro ročníky 5 – 9. Odpověď na uvedené parametry je zveřejněna zde. Pokud vás tato možnost odpovědi zcela neuspokojuje, pak pomocí automatického chytrého vyhledávání můžete najít další otázky na stejné téma v kategorii Chemie. Pokud odpovědi na podobné otázky neodhalují všechny potřebné informace, použijte tlačítko v horní části webu a formulujte svou otázku jinak. Na této stránce také můžete vidět reakce uživatelů.

Mluvím o hliníku Hliník je lehký, odolný a tažný kov. Jedná se o jeden z nejoblíbenějších kovů a pokud jde o míru růstu spotřeby, dlouho zaostává s velkým náskokem za ocelí, niklem, mědí a zinkem. Hliník lze bez nadsázky nazvat.

Protože pH udává úroveň koncentrace vodíkových kationtů ve vodě, což je pro kosmetiku ještě důležitější.

1. daný N(NH3) = 4. 816 * 10 ^ 23 – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – V(NH3 ) – ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4 * 816 ^ 10 * 23 / 22 * 4 ^ 6 = 02 L odpověď 10 L 23) vzhledem k m(15)..

Správná odpověď tedy bude: 4) KCl; 5) AgCl; 6) NH4CI.

Dáno W(O) = 47 % – – – – – – – – – – – – – – – – – – E – ? E je neznámý prvek W(O) = Ar(O) * n / M(X2O3) * 100 % 47 % = 16 * 3 / 2x + 48 * 100 % 94x + 2256 = 4800 X = 27 je hliník Al2O3 odpověď hliník .

Pokud to není jasné, napište normálně nebo vyfoťte.

V SO3 32 / (32 + 3 * 16) = 0, 4 nebo 40 %.

Reakce jsou na fotce.

4HCl + MnO2 = MnCl2 + Cl2 + 2H2O kyselina chlorovodíková uvolňuje polovinu dostupného chloru ve volné formě. M(Cl celkem) = 1000 x 0 x 365 = 0 g hmotnost uvolněného chloru = 9726/355 = 355 g.

Typy chemických reakcí: spojení, rozklad, nahrazení.
© 2000–2023. Při úplném nebo částečném použití materiálů je odkaz povinný. 16+
Tato stránka je chráněna technologií reCAPTCHA, na kterou se vztahují zásady ochrany osobních údajů a smluvní podmínky společnosti Google.





